Contenido de Jabón
Objetivo
Determinar el contenido de jabón en una muestra de aceite por su alcalinidad como oleato de sodio mediante el método de titulación.
Marco Teórico
Este método se basa en la disolución de una porción de grasa, utilizando una mezcla de
solventes (acetona y agua), seguida de una titulación con ácido clorhídrico empleando como
indicador azul de bromofenol.
Introducción
Las grasas y aceites se obtienen a partir de fuentes vegetales y animales. Están constituidos por triglicéridos, que son esteres de una molécula de glicerina con tres ácidos grasos. La mayoría de los triglicéridos son mixtos; es decir, 2 o 3 de sus ácidos grasos son diferentes.
Salvo raras excepciones, los ácidos grasos naturales tienen un número par de átomos de carbono, ya que su biosíntesis se produce por unión de grupos acetilo. Los ácidos grasos insaturados naturales son generalmente isómeros cis. La presencia de dobles enlaces cis altera la forma lineal recta de los ácidos grasos y les da una forma angular. Por eso las moléculas de los ácidos grasos saturados (estructura lineal en zig-zag) presentan un mayor empaquetamiento y sus puntos de fusión son más elevados.
Cuanto mayor es el número de dobles enlaces más inestable es el aceite al oxígeno del aire. El ataque se produce preferentemente en el grupo metileno adyacente a un doble enlace o entre dos dobles enlaces dando lugar a hidroperóxidos. Estos hidroperóxidos se escinden dando aldehídos y cetonas que comunican el típico sabor y aroma rancios, aunque se encuentren en cantidades muy pequeñas.
La extracción de las grasas y aceites naturales y sus transformaciones constituyen un sector industrial de gran importancia económica. Las principales materias primas utilizadas son los sebos y tocinos animales, los huesos, los productos secundarios de las fábricas de harina de pescado (vísceras y extractos), la aceituna y las semillas oleaginosas.
Las grasas animales se extraen calentando con vapor, en autoclaves, los tejidos semitriturados; con ello las grasas se funden y se separan. Se utilizan para fabricar distintos tipos de tensoactivos.
Durante el proceso de neutralización de los aceites y grasas comestibles, se producen
jabones por la neutralización de los ácidos grasos libres por efecto del exceso de álcali y por
la saponificación resultante en pequeña escala que sufre la grasa neutra en este proceso.
La mayor parte de estos jabones se eliminan por centrifugación o decantación y lavados del
aceite o de la grasa y se deben de eliminar totalmente en el proceso de blanqueo.
El contenido de jabón en una grasa constituye un parámetro que valora la calidad del aceite
o grasa comestible.
Cuestionario
1.- Escribe la fórmula de la reacción mediante la cual se forma jabón.
2.- ¿Cuál es la forma de actuar del jabón que permite limpiar?
La estructura de un jabón puede considerarse formada por dos partes:
- Una cadena larga, formada por carbonos en unión covalente;
- El grupo carboxilo, que, al estar disociado, tiene cargas eléctricas.
Si se disuelve jabón en agua y se agrega un aceite, éste (por su menor densidad) forma una fase sobre el agua. Las moléculas de jabón se orientan y se disponen en la interfase con la cabeza hacia el agua y la cola hacia el aceite.
Si se agita este sistema, el aceite se subdivide en gotitas y cada una es rodeada por agua. Las moléculas de jabón se orientan de la manera indicada.
Cada glóbulo de grasa tiene a su alrededor cargas eléctricas del mismo signo que, al repelerse, hacen que las partículas grasas queden separadas entre sí, formando una emulsión estable. En caso contrario, si no existiera el jabón, al agitar el sistema agua – aceite, se formaría en el primer momento una emulsión, pero al cesar la agitación, debido a la gran atracción entre sus moléculas, las gotitas se unirían entre si formando nuevamente dos capas. Se dice, por esta propiedad, que el jabón emulsifica las grasas.
En las superficie de ropas u objetos, la suciedad se adhiere por medio de una película grasa que el agua no puede disolver. Al agregar jabón al agua y agitar, la grasa se emulsifica y forma pequeñas gotas separadas, que son arrastradas por el agua del lavado.
Sabemos que hay aguas que tienen disueltas una elevada proporción de sales de calcio y de magnesio; se las llama aguas duras. En esta clase de agua, el jabón precipita, o sea, se insolubiliza. La causa de este comportamiento es que la sal de sodio o potasio que forma el jabón se combina con los iones calcio o magnesio del agua y forma sales de estos metales, que son insolubles.
3.- ¿Estructuralmente que le ocurre a la grasa durante la reacción de saponificación?
Se disocian las grasas en un medio alcalino, separándose glicerina y ácidos grasos; los cuales se asocian con los álcalis constituyendo las sales sódicas de los ácidos grasos : el jabón.
4.- ¿Cuándo surge históricamente el jabón?
Los primeros indicios en el empleo de jabón por parte del hombre datan del 2.800 a.C. en yacimientos mesopotámicos, habiéndose encontrado allí cilindros de arcilla cubiertos con una sustancia jabonosa. Según reza en una tableta de arcilla del 2.200 a. C, el jabón se elaboraba con agua, sales alcalinas y aceite de acacia.
5.- ¿ Los jabones son fuente de contaminación?
Los residuos de jabón sufren descomposición por la acción de microorganismos existentes en el agua de los ríos, siendo así se vuelven biodegradables, es decir, no contaminan el medio ambiente. Los detergentes a su vez se acumulan en los ríos formando una capa de espuma. En el agua hay microorganismos productores de enzimas capaces de romper las moléculas de cadena carbónica lineal que caracterizan los jabones. Esas enzimas no reconocen las cadenas ramificadas presentes en los detergentes, y por eso ellos permanecen en el agua sin sufrir descomposición, lo que provoca la contaminación. Las espumas de contaminación impiden la entrada de gas oxígeno en el agua, lo que afecta a las formas aeróbicas acuáticas.
Los detergentes son productos que se usan para la limpieza y están formados básicamente por un agente tenso-activo que actúa modificando la tensión superficial del agua, disminuyendo la fuerza de adhesión de las partículas (mugre) a una superficie. La mayoría de los detergentes contienen sosa, la cual mata los microorganismos que viven en el agua y que tienen como función natural degradar o digerir los residuos de nuestros desechos. Otro caso es la eutrofización esto se debe a que los detergentes usan fosfatos o percaboxilatos como potenciadores , estas actúan como fertilizantes de algas haciendo que se reproduzcan muy rápido y la cantidad de estas agota el oxigeno del agua y deja de ser disponible a la fauna acuática.
También nos percatamos que al momento de llevar a cabo la titulación se gastaron pocos ml debido a que la norma establece en su procedimiento el uso de una microbureta, pero al no contar con material suficiente, se realizó con una bureta de 25ml.
En la obtención de los resultados, en su mayoría fueron correctos a excepción de los cálculos que se realizaron para saber la normalidad del ácido clorhídrico. Concluimos pues, que cada sustancia fue separada debido a sus respectivas densidades; asimismo que al momento de determinar la normalidad del ácido se gastaron demasiados ml del agente a causa de que este estaba muy diluido
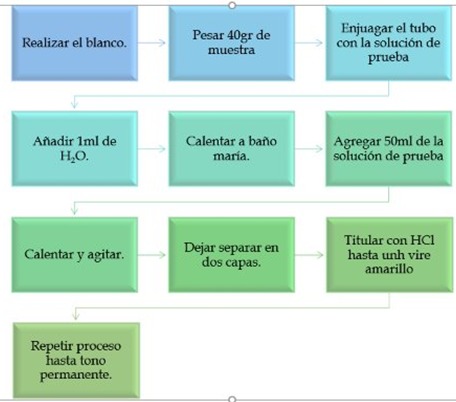
DIAGRAMA DE FLUJO:
ANÁLISIS DE RESULTADOS
En la práctica de determinación de jabón observamos que nuestra muestra tuvo una coloración azul al agregar la solución de prueba, nuestra técnica nos dice que un vire de este color da como positivo a la presencia de jabón en nuestro aceite. Como podemos ver en los vídeos mostrados a continuación de este segmento de artículo, el jabón quedo unido al aceite en la parte superior, esto se debe a que el aceite tiene una densidad de 0.9 (dependiendo del aceite que utilicemos este valor variará) por lo que en la parte superior se quedaron los residuos de nuestra preparación, la capa gruesa tuvo que ser titulada para poder tener un vire de color amarillo y mantener caliente hasta que este amarillo este permanente. De acuerdo con la NOM, nuestro aceite presenta rangos de jabón admitidos, ya que no supero el 1% de jabón.
CONCLUSIONES:
Al haber realizado la práctica llegamos a distintas conclusiones; tales como la importancia de la determinación del contenido de jabón ya que esta representa gran parte de la naturalidad y purezas en grasas o aceites.También nos percatamos que al momento de llevar a cabo la titulación se gastaron pocos ml debido a que la norma establece en su procedimiento el uso de una microbureta, pero al no contar con material suficiente, se realizó con una bureta de 25ml.
En la obtención de los resultados, en su mayoría fueron correctos a excepción de los cálculos que se realizaron para saber la normalidad del ácido clorhídrico. Concluimos pues, que cada sustancia fue separada debido a sus respectivas densidades; asimismo que al momento de determinar la normalidad del ácido se gastaron demasiados ml del agente a causa de que este estaba muy diluido





No hay comentarios.:
Publicar un comentario